Contoh Soal Hukum Proust: Pahami Hukum Perbandingan Tetap
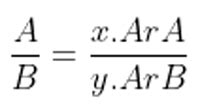
Berikut ini adalah beberapa contoh soal hukum Proust untuk membantu Anda memahami konsep hukum perbandingan tetap dalam kimia. Hukum Proust, juga dikenal sebagai hukum perbandingan tetap, menyatakan bahwa suatu senyawa kimia selalu tersusun dari unsur-unsur penyusunnya dengan perbandingan massa yang tetap, terlepas dari sumber atau cara pembuatan senyawa tersebut.
Memahami Hukum Proust: Perbandingan Tetap dalam Senyawa
Hukum Proust merupakan hukum dasar dalam kimia yang menjelaskan komposisi tetap suatu senyawa. Contoh soal hukum Proust akan mengilustrasikan bagaimana perbandingan massa unsur-unsur dalam senyawa selalu konstan. Kemampuan memahami hukum proust sangat penting dalam berbagai perhitungan kimia.
Contoh Soal Hukum Proust 1: Air
Air (H₂O) selalu tersusun dari hidrogen dan oksigen dengan perbandingan massa tertentu. Jika kita menganalisis beberapa sampel air dari berbagai sumber (air hujan, air laut, air sumur), perbandingan massa hidrogen terhadap oksigen akan selalu konstan, yaitu sekitar 1:8.
Soal: Sebuah sampel air memiliki massa 18 gram. Jika perbandingan massa hidrogen terhadap oksigen dalam air adalah 1:8, tentukan massa hidrogen dan oksigen dalam sampel tersebut.
Jawaban:
- Total perbandingan massa = 1 + 8 = 9
- Perbandingan massa karbon terhadap oksigen pada sampel pertama = 3:8 = 3/8
- Perbandingan massa Fe₂ : O₃ = 112 : 48
Massa hidrogen = (1/9) 18 gram = 2 gram
Massa oksigen = (8/9) 18 gram = 16 gram
Contoh Soal Hukum Proust 2: Karbon Dioksida
Karbon dioksida (CO₂) juga mengikuti hukum Proust. Perbandingan massa karbon terhadap oksigen dalam CO₂ selalu konstan.
Soal: Dua sampel karbon dioksida dianalisis. Sampel pertama memiliki 3 gram karbon dan 8 gram oksigen. Sampel kedua memiliki 6 gram karbon. Berapa gram oksigen yang terdapat dalam sampel kedua?
Jawaban:
Massa oksigen pada sampel kedua = (8/3) 6 gram = 16 gram
Contoh Soal Hukum Proust 3: Senyawa Besi Oksida
Sebuah senyawa besi oksida memiliki rumus kimia Fe₂O₃. Analisis menunjukkan bahwa senyawa tersebut mengandung 112 gram besi. Berapa gram oksigen yang terdapat dalam senyawa tersebut? (Ar Fe = 56, Ar O = 16)
Jawaban:
Massa atom relatif (Ar) Fe₂ = 2 56 = 112
Massa atom relatif (Ar) O₃ = 3 16 = 48
Massa oksigen = (48/112) 112 gram = 48 gram
Kesimpulan
Contoh soal hukum Proust di atas menunjukkan bagaimana perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap. Memahami hukum perbandingan tetap ini sangat penting dalam berbagai perhitungan stoikiometri dan analisis kimia. Pelajari contoh-contoh soal ini dengan baik agar pemahaman Anda tentang hukum Proust semakin mantap.
Tanya Jawab
Q: Apakah hukum Proust berlaku untuk semua jenis senyawa?
A: Ya, hukum Proust berlaku untuk senyawa murni. Namun, hukum ini tidak berlaku untuk campuran karena komposisi campuran dapat bervariasi.
Q: Bagaimana hukum Proust berbeda dengan hukum Dalton?
A: Hukum Proust membahas perbandingan massa unsur dalam senyawa yang tetap, sedangkan hukum Dalton membahas hukum perbandingan berganda, yaitu bahwa unsur-unsur dapat bereaksi membentuk lebih dari satu senyawa dengan perbandingan massa yang berbeda.
Q: Di mana kita dapat menemukan aplikasi praktis dari hukum Proust?
A: Hukum Proust diterapkan dalam berbagai analisis kimia, seperti penentuan rumus empiris senyawa dan perhitungan stoikiometri.
Semoga penjelasan dan contoh soal hukum Proust ini bermanfaat!